बोर्न हेबर चक्र –
बन्ध लम्बाई (Bond Length)
बन्ध की बन्ध लम्बाई बन्ध बनाने वाले परमाणुओं के नाभिकों के मध्य की दूरी होती है। इसे सामान्यतः एंगस्ट्रॉम (Angstrom) इकाई में व्यक्त करते हैं। बन्ध लम्बाई निम्नलिखित कारकों पर निर्भर करती है-
(i) परमाणु आकार (Atomic Size)-परमाणु आकार बड़ा होने पर बन्ध बनाने वाले परमाणुओं के नाभिक अधिक निकट नहीं आ पाते हैं। अतः बन्ध लम्बाई अपेक्षाकृत अधिक हो जाती है। इस प्रकार हम कह सकते हैं कि परमाणु का आकार जितना अधिक होता है, बन्ध लम्बाई उतनी ही अधिक होती है।
(ii) बन्ध बहुलता (Multiplicity of Bonds)-बन्ध बनाने वाले परमाणुओं के मध्य एक से अधिक बन्ध होने पर बन्ध लम्बाई कम हो जाती है। अतः परमाणुओं के मध्य बनने वाले बन्धों की संख्या जितनी अधिक होती है बन्ध लम्बाई उतनी ही कम होती है।
बोर्न हेबर चक्र क्या होता है कैसे बनता है सारा कुछ इस post में जानेगे उससे पहले हमें छोटी-छोटी परिभाषाओं को जानना बहुत जरूरी है , जैसे जालक ऊर्जा, आयनन ऊर्जा, इलेक्ट्रॉन बंधुता , यह सब कुछ आज हम देखेंगे
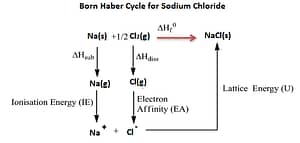
बोर्न हेबर ने सन 1919 में आयनिक बंध निर्माण की क्रियाबिधि का अध्ययन किया | इनके अनुसार आयनिक बंध पांच पदों में बनता है इन पांच पदों को एक क्रम में व्यवस्थित करने पर एक चक्र बनता है जिसे बोर्न हेबर चक्र कहते है इसे NaCl के निर्माण की क्रियाबिधि से समझाया जा सकता है |
NaCl के निर्माण की क्रिया-बिधि निम्न पांच पदों में होती है –
- उर्ध्वपातन उर्जा – एक मोल ठोस को गैस में बदलने के लिए लगने वाली उर्जा उर्ध्वपातन उर्जा कहलाती है | इसे S द्वारा दर्शाते है |
- आयनन उर्जा – उदासीन एकल गैसीय परमाणु से एक इलेक्ट्रान निकालने में लगने वाली उर्जा आयनन उर्जा कहलाती है
- वियोजन उर्जा – वियोजन (Dissociation) उस प्रक्रिया को कहते हैं जिसमें अणु टूटकर छोटे कणों, परमाणुओ के रूप में बदल जाते हैं। यह क्रिया प्रायः उत्क्रमणीय होती है।
4.इलेक्ट्रान बंधुता –
उदासीन एकल गैसीय परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने पर निकलने में लगने वाली उर्जा इलेक्ट्रान बंधुता कहलाती है |
5. जालक उर्जा –
गैसीय अवस्था में धनायन एवं ऋण आयन एक दुसरे को आकर्षित करके एक मोल ठोस का निर्माण करते है , इस दोरान निकलने वाली उर्जा जालक उर्जा कहलाती है |
- इसे U से दर्शाते है |
- यह हमेशा ऋणात्मक होती है
उपर्युक्त पांचो पदों को एक क्रम में व्यवस्थित करने पर एक चक्र बनता है जिसे बोर्न हेबर चक्र कहते है |
बोर्न हेबर चक्र के उपयोग –
इनके अनुसार NaCl के समभवन की ऊष्मा पांच पदों की उर्जा के योग के बराबर होती है |
- अधातुओ के इलेक्ट्रान बंधुता की गणना |
- धातुओ के आयनन उर्जा की गणना करना |
- आयनिक यौगिको की जालक उर्जा की गणना करना |
- समभवन-ऊष्मा की गणना करना |
द्विध्रुव आघूर्ण : किसी ध्रुवीय अणु में किसी एक परमाणु पर उपस्थित आवेश की मात्रा (q या e) तथा दोनों परमाणुओं के नाभिकों के मध्य की दूरी (d या r) के गुणनफल को द्विध्रुव आघूर्ण कहलाता है |
- इसे μ से व्यक्त करते है।
μ = q x d
- द्विध्रुव आघूर्ण की इकाई “डिबाई” होती है जिसे D से व्यक्त करते है।
1 D = 10−18 e.s.u X c. m
- द्विध्रुव एक सदिश राशि होती है।
किसी अणु की ध्रुवीयता को व्यक्त करने के लिए उसके ऊपर तीर (→) का निशान लगाया जाता है।
- तीर का निशान कम विद्युत ऋणी परमाणु की तरफ लगाते है।
- वे अणु जो दो समान परमाणुओं से मिलकर बने होते है उनका द्विध्रुव शून्य होता है।
उदाहरण : H2 , Cl2 , O2 , N2 आदि।
- दो परमाणुओं की विद्युत ऋणात्मकता में जितना ज्यादा अंतर होता है द्विध्रुव आघूर्ण का मान उतना ही अधिक होता है। उदाहरण : H-X का द्विध्रुव आघूर्ण निम्न क्रम में घटता जाता है –
जहाँ -X = -F , -Cl , -Br , -I
H-F > H-Cl > H-Br > H-I
- किसी बहुपरमाण्वीय अणु का द्विध्रुव आघूर्ण उसमें उपस्थित सभी ध्रुवीय बन्धो के द्विध्रुव आघूर्ण के सदिश योग के बराबर होता है।
- वे अणु जिनकी संरचना रेखीय , समतल , त्रिकोणीय तथा चतुष्फलकीय होती है एवं केन्द्रीय परमाणु से जुड़े सभी परमाणु समान होते है तो उनका द्विध्रुव आघूर्ण शून्य होता है तथा ऐसे अणु अध्रुवीय अणु कहलाते है।
उदाहरण : CO2 , BeCl2 आदि।
- वे अणु जिनकी संरचना कोणीय होती है उनका द्विध्रुव आघूर्ण निश्चित होता है तथा ऐसे अणु ध्रुवीय अणु कहलाते है।