परमाणु मॉडल
थॉमसन का परमाणु मॉडल तथा उनकी सीमायें-
थॉमसन का परमाणु मॉडल
इलेक्ट्रॉन एवं धन किरणों की खोज के पश्चात् परमाणु मॉडल की परिकल्पना सर्वप्रथम थॉमसन ने की थी। थॉमसन के अनुसार, परमाणु धनावेश से निर्मित एक गोलाकार (spherical) संरचना है जिसमें उस पर उपस्थित धनावेश के बराबर इलेक्ट्रॉन अन्तःस्थापित अथवा वितरित रहते हैं यह परिकल्पना ब्रिटेन की डिश प्लम पुडिंग (plum pudding) पर आधारित थी। अत: इस परमाणु मॉडल को प्लम पुडिंग मॉडल भी कहा जाता है। इस मॉडल में परमाणु आकार 10-8 सेमी. माना गया है।
सीमायें (Limitations)-
- यह मॉडल धनावेशित भाग के अन्दर इलेक्ट्रॉन के ऋणावेश सहित उपस्थित रहने का कारण नहीं समझा सकता।
- हाइड्रोजन स्पेक्ट्रम की व्याख्या नहीं कर सकता।
- सूक्ष्म मॉडल के आधार पर रदरफोर्ड द्वारा अपने एक प्रयोग में प्रदर्शित परमाणु से टकराकर धनावेशित भारी अल्फा कणों के प्रकीर्णन की व्याख्या नहीं कर सकता।
रदरफोर्ड का परमाणु मॉडल (Rutherford’s Atomic Model)
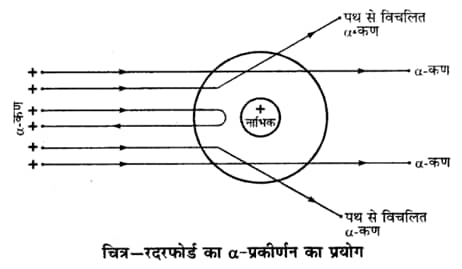
परमाणु रचना का वर्तमान ज्ञान रदरफोर्ड की परमाण्वीय धारणा (atomic concept) पर आधारित है। इस धारणा को उन्होंने सन् 1911 में प्रकाशित किया था। उन्होंने यह देखा कि जब स्वर्णधातु के अत्यन्त पतले पत्तरों (0.00004 सेमी) पर किसी रेडियोऐक्टिव पदार्थ से प्राप्त अल्फा कणों (α -particles) से आघात किया जाता है
तब निम्नलिखित परिणाम प्राप्त होते हैं
|
- बहुत से α-कण (α -particles) पत्तर के आर-पार सीधी रेखा में चले जाते हैं।
- कुछ कण अपने पूर्व-पथ से विक्षेपित हो जाते हैं।
- लगभग 20000 में से एक अल्फा कण अपने चलने वाले पूर्व मार्ग पर ही वापस लौट आता है।
उपरोक्त प्रेक्षणों के आधार पर रदरफोर्ड ने परमाणु संरचना सम्बन्धी कुछ निष्कर्ष निकाले जो निम्न प्रकार हैं-
- परमाणु का अधिकांश भाग रिक्त होता है, क्योंकि अधिकतम कण स्वर्ण पत्र के पार निकल जाते हैं।
- कुछ अल्फा कण का विभिन्न कोणों से विचलित होना यह सिद्ध करता है कि परमाणु में धन आवेशित भाग होता है | यह केन्द्र बिन्दु नाभिक (nucleus) कहलाता है।
- नाभिक अत्यन्त सूक्ष्म (10-13 सेमी) ठोस व दृढ़ भाग है।
परमाणु मॉडल परिकल्पना–
उपरोक्त निष्कर्षों के आधार पर रदरफोर्ड ने परमाणु के नाभिकीय मॉडल की परिकल्पना की।
- उसके अनुसार, परमाणु में धनावेशित तथा समस्त द्रव्यमान युक्त नाभिक के अतिरिक्त रिक्त स्थान होता है।
- इस रिक्त स्थान में नाभिक के धनावेश के बराबर ऋण आवेश रखने वाले इलेक्ट्रॉन भ्रमण करते रहते हैं
- इलेक्ट्रॉनों का यह भ्रमण सूर्य के चारों ओर घूमते ग्रहों की भाँति है अर्थात् सौरमण्डल की भाँति इलेक्ट्रॉन कक्षाओं में नाभिक के चारों ओर भ्रमण करते रहते है।
- इलेक्ट्रॉनों का अपकेन्द्रीय बल (centrifugal force) कूलॉम्बिक बल के बराबर होता है।
सीमायें (Limitations)-
परमाणु संरचना की इस प्रकार व्याख्या करने के पश्चात् भी रदरफोर्ड परमाणु मॉडल की अपनी सीमाएँ हैं। यह परमाणु मॉडल निम्नलिखित प्रमुख दोष दर्शाता है-
- परमाणु के स्थायित्व तथा उसके विविक्त स्पेक्ट्रम की व्याख्या न कर पाना।
- Maxwell के अनुसार जब आवेशित कण चक्कर लगाता है तो वह अपनी ऊर्जा को विद्युत चुंबकीय तरंगों के रूप में उत्सर्जित करता है जिससे उसकी उर्जा में कमी आती है चूकि इलेक्ट्रॉन एक आवेशित कण है जो नाभिक के चारों ओर चक्कर लगाता है इसलिए ऊर्जा को उत्सर्जित करेगा जिससे धीरे धीरे नाभिक के नजदीक आएगा एवं अंत में नाभिक में गिर जाएगा इस प्रकार परमाणु अस्थाई होना चाहिए जबकि परमाणु स्थाई होता है |
- रदरफोर्ड के परमाणु प्रारूप के आधार पर परमाणु का रेखीय स्पेक्टम नहीं समझाया जा सकता |
- रदरफोर्ड के सिद्धांत के अनुसार इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाता है जो ऊर्जा को सतत उत्सर्जित करेगा इसलिए परमाणु का स्पेक्ट्रम सतत होना चाहिए जबकि परमाणु का स्पेक्ट्रम रेखीय होता है |