कोश या कक्षा –
नाभिक के चारो ओर अनेक वृत्ताकार कक्षाएं होती हैं जिनमें इलेक्ट्रॉन चक्कर लगाते हैं इनको कोश या कक्षाओं के नाम से जाना जाता है
- कोश, इलेक्ट्रॉन की वृत्ताकर गति को प्रदर्शित करता है |
- कक्षा की खोज बोर द्वारा की गई |
- किसी इलेक्ट्रॉन को उसको मुख्य क्वांटम संख्या n द्वारा प्रदर्शित किया जाता है |
- K, L, M & N आदि कोश के लिए मान क्रमशः1,2,3 & 4 होगा
- किसी कोश में अधिकतम उपकोश की संख्या = n
- किसी कोश में अधिकतम कक्षको की संख्या = n2
- किसी कोश में अधिकतम इलेक्ट्रॉनों की संख्या = 2n2
| कक्षा | n के मान | उपकोश की संख्या | कक्षको की संख्या | इलेक्ट्रॉनों की संख्या |
| K | 1 | 1 | 1 | 2 |
| L | 2 | 2 | 4 | 8 |
| M | 3 | 3 | 9 | 18 |
| N | 4 | 4 | 16 | 32 |
उपकोश
Sommerfeld के अनुसार इलेक्ट्रॉन वृत्ताकार के साथ दीर्घ वृत्ताकार कक्षा में चक्कर लगाते हैं इनको उपकोशो के नाम से भी जाना जाता है |
- उपकोश इलेक्ट्रॉन की वृत्ताकार एवं दीर्घ वृत्ताकार गति को प्रदर्शित करते हैं
- उपकोश की खोज समरफील्ड द्वारा की गई एवं निर्धारण दिगंसीय क्वांटम संख्या द्वारा किया गया |
- S, p d & f उपकोशो के लिए l का मान क्रमशः 0,1,2 & 3 होता है |
- किसी उपकोश में कक्षको की संख्या 2 l + 1 होता है |
- किसी उपकोश में अधिकतम इलेक्ट्रान की संख्या [2 l + 1] होता है |
| उपकोश | l के मान | कक्षको की संख्या 2 l + 1 | इलेक्ट्रॉन की संख्या 4 l +2 |
| S | 0 | 1 | 2 |
| P | 1 | 3 | 6 |
| D | 2 | 5 | 10 |
| f | 3 | 7 | 14 |
कक्षक [ orbitals ]
परमाणु के नाभिक के चारों ओर का वह क्षेत्र जिसमे इलेक्ट्रॉन पाए जाने की संभावना [90-95 %] अधिकतम होती है, परमाणु कक्षक कहलाता है |
- परमाणु कक्षा इलेक्ट्रॉन की त्रिविमीय गति को प्रदर्शित करता है
- परमाणु कक्षक की खोज ………………………….द्वारा की गई |
- किसी परमाणु कक्षक का निर्धारण चुंबकीय क्वांटम संख्या द्वारा दर्शाया गया है
- Pauli के नियम अनुसार किसी भी एक परमाणु कक्षक में अधिकतम विपरीत चक्र वाले दो इलेक्ट्रॉन भर सकते हैं|
- किसी कक्षा में इलेक्ट्रॉन का कोणीय संवेग [l(l + 1)]1/2 h/2π होता है |
- कक्षको का आकार मुख्य क्वांटम संख्या पर निर्भर करता है मान बढाने पर बढ़ेगा |
- कक्षको की आकृति दिग्न्सीय क्वांटम संख्या (l) पर निर्भर करता है |
S, p, & d कक्षको की आकृति
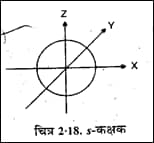
- s- कक्षक की आकृति–s- कक्षक s उपकोश में होता है इसके लिए l और m दोनों के मान शून्य होते हैं | m का शून्य मान इस कक्षक का एक ही विन्यास दर्शाता है | अतः इसकी आकृति गोलाकार होती है जिसमे सभी अक्षो पर समान इलेक्ट्रॉन घनत्व पाया जाता है |

s – orbital
| प्रत्येक कोश के s-कक्षक यद्यपि समान आकृति रखते हैं। परन्तु उनके आकार में भिन्नता पायी जाती है। भिन्न-भिन्न कोशों के s- कक्षकों के मध्य रिक्त स्थान को जहाँ इलेक्ट्रॉन घनत्व पाये जाने की प्रायिकता शून्य है, नोडल तल (nodal surface) या नोड (node) कहते हैं। |
- P-कक्षक आकृति – p-कक्षक p-उपकोश में होते हैं। p- उपकोश के लिए l का मान एक होता है। l = 1 के लिए m के तीन मान [-1,0 तथा +1] होते हैं। ये क्रमशः तीन कक्षक px. Py. तथा pz के लिए हैं। p-कक्षक अक्षों पर इलेक्ट्रॉन घनत्व रखते हैं। तथा इनकी आकृति डमरू की भाँति होती है। तीनों p-कक्षक एक-दूसरे के लम्बवत् होते हैं। प्रत्येक p-कक्षक की दो पालियों (lobes) के मध्य जहाँ इलेक्ट्रॉन घनत्व पाये जाने की प्रायिकता शून्य है, नोडल तल पाया जाता है।

- d-कक्षक आकृति– d-कक्षक, d-उपकोश में पाये जाते हैं d-उपकोश के लिए l का मान 2 होता है। अतः इसमें कुल कक्षक m के कुल मान 2 l + 1 के बराबर अर्थात् 5 होंगे। ये पाँच कक्षक [dxy dyz dxz, dx2-y2 & dz2 ] संकेतों द्वारा दर्शाये जाते हैं। प्रथम तीन कक्षक अक्षों के मध्य व अन्तिम दो अक्षों पर अभिविन्यासित होते हैं।

p-orbitals - https://akashlectureonline.com/रदरफोर्ड-का-परमाणु-मॉडल/
- दोस्तों स्वागत है आपका अपने पेज www.akashlectureonline.com पर दोस्तों , आज हम देखेंगे कक्षा 11 का अध्याय 2 | इस पेज पर आपको पढाई से संबंधित ब्लॉग मिलेगे , हम आशा करते है, कि आपको यह पोस्ट बेहद पसंद आई होगी | अगर आप चाहे तो इसके वीडियो लेक्चर भी आप देख सकते है
- जिसमे आपको अच्छी तरह से समझाया जायेगा | आप हमारे YOUTUBE चैनल akash lecture online पर जाकर वीडियो को देख सकते है | इस चैनल पर आपको इस पोस्ट से संबंधित सभी वीडियो मिल जायेंगे | हमारा उद्देश है आप सभी को अच्छी शिक्षा देना है | वीडियो देखने के बाद भी अगर आपके मन में कोई doubt है तो आप कमेंट में अपना डाउट लिखकर हमारे साथ शेयर कर सकते है , हम आपकी समस्या का जरुर हल निकालेंगे |